Il 29 dicembre 2022 è stato approvato il Modernization of Cosmetics Regulation Act (MoCRA), che è il primo importante emendamento al capitolo VI del Federal Food, Drug and Cosmetic Act (FDCA), risalente al 1938.
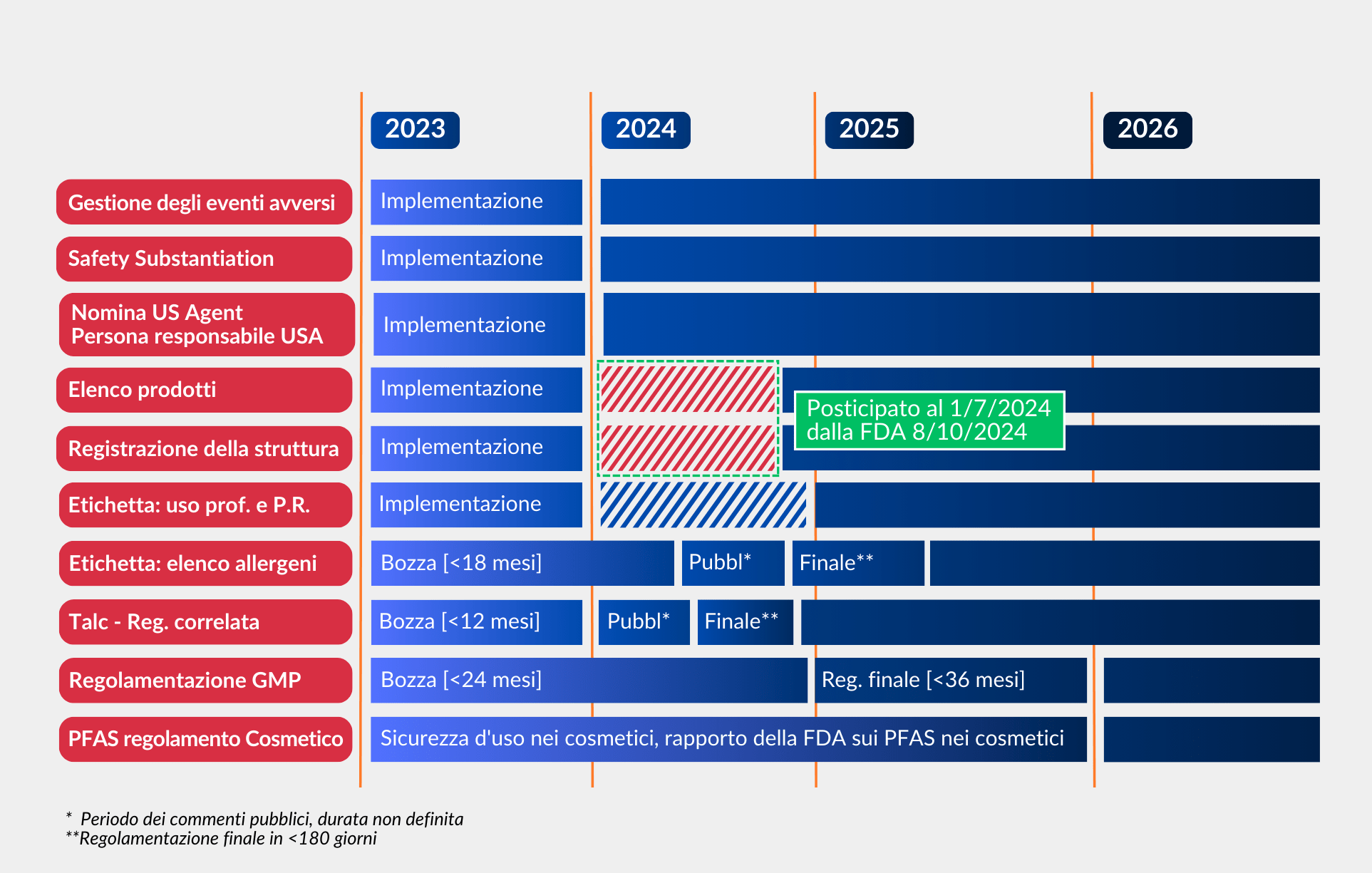
Entrerà in vigore il 29 dicembre 2023 e prevede l’introduzione di nuovi obblighi che le aziende che vendono prodotti cosmetici negli Stati Uniti dovranno rispettare.

US Responsible Person/US Agent: un ruolo chiave!
Il più importante cambiamento concerne l’identificazione di una US Responsible Person, che dovrà essere indicata in etichetta e dovrà essere in contatto con l’FDA. Le aziende non residenti negli USA potranno mantenere questo ruolo, ma dovranno indicare un riferimento locale che dovrà avere elevate competenze nell’interazione con l’FDA, nella gestione degli Adverse Events ma soprattutto dovrà gestire e custodire informazioni confidenziali. A tale scopo offriamo il ruolo di US Agent, garantendo competenza, professionalità e riservatezza. Oltre a garantire gli obblighi di legge, forniremo assistenza costante e aggiornamenti in tempo reale, tutelando la prosperità del vostro business negli USA! I produttori coinvolti dovranno essi stessi procedere con la nomina dello US Agent che si occuperà della registrazione degli impianti e otterrà il numero FEI (FDAEstablishment Identifier). Grazie alle nostre competenze, offriamo il ruolo di US Agent per rappresentare i siti produttivi, garantendo tutela, competenza e discrezione.
I nostri punti di forza:
- Competenza normativa: Sfrutta la nostra profonda conoscenza del MoCRA e altre normative pertinenti per garantire la conformità ai requisiti cosmetici statunitensi.
- Collegamento con la FDA: Saremo il tuo punto di contatto diretto con la FDA, facilitando la comunicazione e affrontando eventuali domande o preoccupazioni normative.
- Gestione della conformità: Implementiamo sistemi e processi robusti per monitorare e mantenere la conformità con tutte le normative applicabili.
- Registrazione del prodotto (elenco dei prodotti): assistenza nel processo di registrazione dei prodotti cosmetici, garantendo che tutta la documentazione necessaria venga inviata in modo accurato e puntuale.
- Numero FEI: in qualità di US Agent nominato, forniremo alle strutture il FDA Establishment Identifier (FEI) number
- Segnalazione degli eventi avversi: Gestisci gli eventi avversi previsti da MoCRA, garantendo una segnalazione tempestiva e accurata quando necessario.

CARB SURVEY!
Termine massimo: 14 gennaio e 8 aprile 2025! Sei pronto? Contattaci!
California Air Resources Board (CARB)
The California Air Resources Board’s 2023 Consumer and Commercial Products Survey
Il futuro della cosmetica negli USA
Come prepararsi in maniera efficace all’arrivo del MoCRA
• Modalità e tempistiche della conformità ai nuovi requisiti
• Cosa fare subito e come predisporre i prossimi passi
• Le principali novità: registrazione stabilimento, listing dei prodotti, Good Manufacturing Practices (GMP), valutazione della sicurezza, nuovi requisiti di etichettatura, reporting degli eventi avversi, tenuta dei registri
I riferimenti normativi
• Approvata dal Congresso degli Stati Uniti il 23 dicembre 2022
• Gli emendamenti MoCRA al capitolo VI del Federal Food, Drug, and Cosmetic Act(FDCA) costituiscono la prima importante modifica sui cosmetici dal 1938 ed introducono 10 nuove sezioni in aggiunta alle 3 già presenti
• La nuova legge consente ora alla FDA di esercitare maggiore autorità sulle aziende cosmetiche
MoCRA: perché?
• Normativa del 1938 • Normativa Frammentata • Sicurezza del prodotto non dimostrata e non documentata • Scarsa protezione per i consumatori • FDA: limitato potere di azione

Safety Substantiation
chi ha detto «PIF»?
• Dimostrazione scientifica sulla sicurezza del prodotto e degli ingredienti
• Sempre supportata ed accompagnata dalla documentazione necessaria
• Sempre valida ed attuale, in costante ed incessante aggiornamento
• Tramite i dovuti studi approfonditi, test, analisi, prove ed informazioni -> dati tossicologici
• Esperto Qualificato con competenza documentata ed esperienza -> Safety Assessor
• Valutazione della Sicurezza inerente il prodotto e gli ingredienti -> dati tossicologici
 U.S. Responsible Person
U.S. Responsible Person
• Residente in U.S.A., altrimenti può essere incaricato uno US Agent
• Referente unico delle autorità
• Registrazioni: product listing, facility registration
• Gestione dei Serious AdverseEvents
• Safety Substantiation
• Competenze specifiche in ambito regolatorio
AGENTE degli USA nominato dal fabbricante per la registrazione dei propri impianti.
Valutare con attenzione la nomina di un distributore locale per confidenzialità delle informazioni sui prodotti/fornitori, affidabilità delle sue competenze regolatorie e scientifiche, esperienza e capacità nel rapporto con le autorità e nella conservazione dati.
Registrazioni: non solo brand
FACILITY REGISTRATION
deve essere nominato un agente statunitense
produttori e attori della filiera produttiva – da rinnovare ogni 2 anni – aggiornamenti entro 60gg
Esistenti: registrarsi entro il 29 dicembre 2023
Nuove: registrarsi entro 60gg dall’attivazione
Informazioni necessarie
• RIFERIMENTI: nome, indirizzo, e-mail e numero di telefono
• CONTATTI RP: contatto della U.S. RP alla quale i prodotti fanno riferimento
• CATEGORIE: categorie cosmetiche dei prodotti realizzati e riferimento delle U.S. RP per ogni prodotto
• N° REGISTRAZIONE: eventuale numero di registrazione pregresso
• BRAND: nomi dei brand realizzati
Registrazioni: prodotti e ingredienti
PRODUCT LISTING
U.S. Responsible Person – info su prodotti e ingredienti – da aggiornare ogni anno
Informazioni necessarie
• N° REGISTRAZIONE: Facility Registration Number
• RIFERIMENTI RP: nome e contatto della U.S. RP, come appare sul prodotto
• CATEGORIA: categoria cosmetica d’appartenenza
• INGREDIENTI: elenco completo degli ingredienti
• PLD: Product Listing Number eventualmente pregresso
Etichettatura
• Stesso frame di riferimento pregresso – Principal Display Panel (PDP) e Information Panel (IP)
• Prodotti per uso professionale – Warning in etichetta
• Riferimenti U.S. Responsible Person – Indirizzo, telefono, email, sito web
• Allergeni delle fragranze – Elenco da definire, plausibile allineamento con elenco EU
Serious Adverse Events
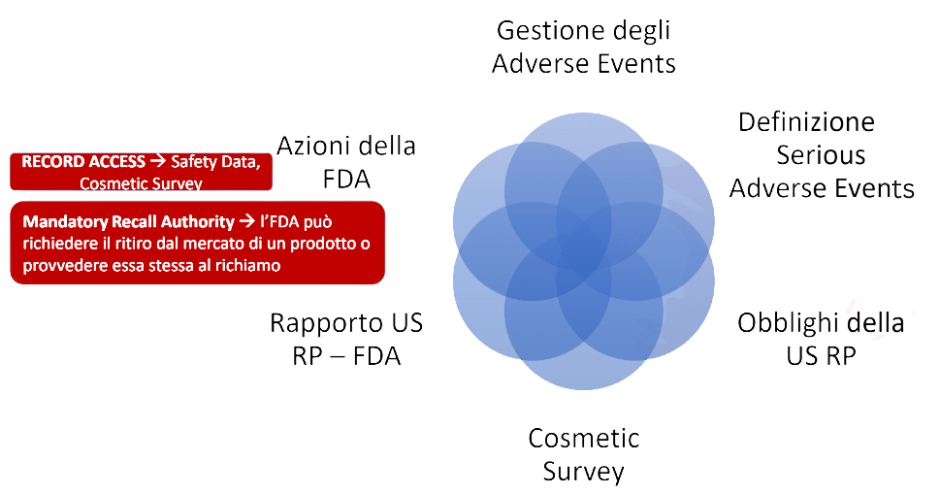
Definizione simile all’effetto indesiderato grave (SUE) della norma EU
La U.S. Responsible Person deve:
• inviare relazione e copia dell’etichettatura del prodotto, entro 15 giorni dalla ricezione della segnalazione
• aggiornamento medico (New MedicalInformation): per 1 anno dall’evento, entro 15 giorni dalla ricezione degli ulteriori dati
• ricezione delle segnalazioni: agli indirizzi (fisico, email e sito web) della US RP
• mantenimento dei record per 6 anni
• accesso a personale autorizzato del Department of Health and Human Services
FDA: sospetto su componenti della fragranza
• può richiedere l’elenco di tutti i prodotti che le contengono
• la U.S. Responsible Person deve fornire l’elenco entro 30 giorni
Good Manufacturing Practice
• Atteso allineamento sostanziale con le ISO 22716
• Final Rule entro il 29 dicembre 2024
• In definizione: fase di raccolta dati
• Obbligo di applicazione: 29 dicembre 2025
Piano d’azione
Cosa fare ora:
• identificare una persona responsabile negli Stati Uniti / agente statunitense
• organizzare la gestione degli AdverseEffects(CosmeticSurvey)
• Safety Substantiation – documentata, in inglese, aggiornata, dati
• etichettatura -conforme
Cosa fare prossimamente:
• registrazione dei prodotti (con listingingredienti), produttori e attori della filiera
• ispezioni(GMP) da parte dell’FD
Siamo pronti a supportarti nella gestione di questo importante aggiornamento al fine di proteggere la tua attività e le tue informazioni riservate garantendo la massima sicurezza.

